揭秘单卵细胞球本质特性及其与单卵细胞的发育关联机制
摘要
单卵细胞球(Oocyst)作为原生动物门孢子虫纲生物(如疟原虫)生命周期中的关键结构,其形成与发育直接决定病原体的传播能力。从细胞生物学与分子遗传学角度,系统阐述单卵细胞球在减数分裂激活、孢子生殖启动等环节的独特性状,揭示其与母体单卵细胞在表观遗传修饰、极性建立等层面的调控关联,为阻断病原体传播提供理论依据。
单卵细胞球的生物学特性解析
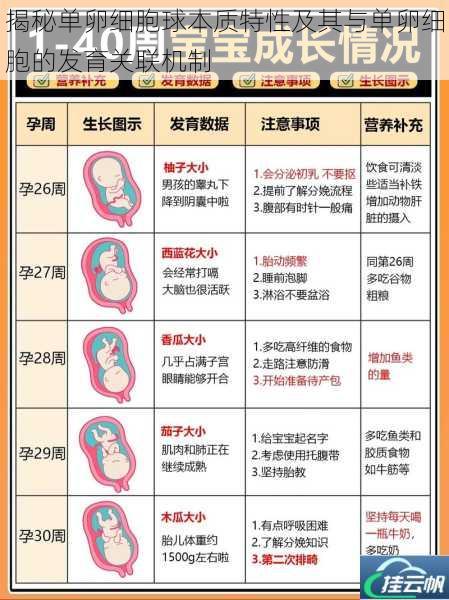
单卵细胞球是疟原虫等孢子虫在蚊媒体内发育的核心过渡结构。当雌雄配子在蚊胃腔内完成受精后,合子分化为运动型动合子(ookinete),穿透蚊胃上皮形成卵囊。此时的卵囊即进入单卵细胞球阶段,其本质为包裹在双层囊壁内的多核合胞体。
1. 结构特异性
单卵细胞球外壁由多层几丁质与脂蛋白构成,具备抗消化酶分解的物理屏障功能。内腔通过核内复制形成数千个二倍体核,这些核在孢子生殖期同步完成减数分裂,产生单倍体子孢子。这种多核同步发育模式显著区别于哺乳动物卵母细胞的单细胞异步成熟机制。
2. 代谢重编程特征
单卵细胞球通过激活糖酵解与脂肪酸β-氧化途径获取能量,线粒体嵴结构退化为管状网络,这与哺乳动物卵母细胞依赖氧化磷酸化的代谢策略形成鲜明对比。这种代谢转换由TORC1激酶通路调控,确保在营养匮乏的蚊血淋巴环境中维持发育进程。
3. 表观遗传调控网络
组蛋白H3K9ac修饰在动合子向卵囊转化阶段显著富集,驱动孢子生殖相关基因(如SPECT、TRAP家族)的时序性表达。相比之下,单卵细胞在减数分裂阻滞期间依赖H4K20me3修饰维持基因组稳定性,显示两者在表观调控层面的进化分异。
单数细胞球与单卵细胞的发育关联机制
1. 减数分裂启动的分子开关
单卵细胞球的减数分裂发生于孢子生殖中期,由钙振荡信号触发。研究表明,Plasma Membrane Calcium ATPase(PMCA)在卵囊质膜上的极性分布,导致局部钙离子浓度梯度形成,从而激活钙调素依赖性蛋白激酶(CDPK1)。此机制与哺乳动物卵母细胞中IP3R介导的钙释放存在同源性,但时序调控更为严格。
2. 母源因子传递的保守性
单卵细胞球内储存的母源mRNA(如CCp2、CCp3)通过结合RNA结合蛋白DOZI形成翻译抑制复合物,直至孢子形成阶段被磷酸化解离。这一调控策略与脊椎动物卵母细胞中CPEB介导的mRNA翻译抑制具有功能趋同性,提示早期后生动物发育程序的深层保守机制。
3. 细胞极性建立的分子基础
卵囊顶端复合体(apical complex)的组装依赖于IMC1蛋白与GAP45的动态互作,形成微管组织中心。这种极性建立过程与哺乳动物卵母细胞皮质颗粒的极性分布共享Rho GTPase信号通路,但卵囊通过分泌WISP蛋白定向修饰囊壁,形成机械应力引导的形态发生模式。
发育调控网络的研究突破与医学价值
1. 关键调控因子的鉴定
近年研究发现,疟原虫AP2-O转录因子通过结合卵囊特异性基因启动子区(如CAP380、CIRCUMSPOROZOITE PROTEIN),直接调控孢子生殖进程。基因敲除实验显示,AP2-O缺失导致卵囊停滞在减数分裂前阶段,证明其作为发育计时器的核心地位。
2. 环境信号整合机制
蚊体内温度波动(25-30℃)通过热激蛋白HSP70调控卵囊发育速率,而血餐来源的酪氨酸浓度通过苯丙氨酸羟化酶(PAH)通路影响黑色素沉积,进而调节囊壁抗蚊免疫。这种环境-基因互作网络为开发传播阻断剂提供了新靶点。
3. 转化医学应用前景
针对单卵细胞球囊壁合成的几丁质脱乙酰酶(PfCDA)抑制剂,已进入临床前试验阶段,可有效阻断子孢子释放。基于卵囊特异性抗原Pfs25的传播阻断疫苗,通过诱导抗囊壁抗体,在动物模型中实现78%的传播抑制率。
结论与展望
单卵细胞球作为病原体传播的枢纽结构,其发育机制兼具进化保守性与物种特异性。未来研究需聚焦于:1)单细胞组学技术解析卵囊异质性;2)跨物种比较揭示减数分裂调控的共性规律;3)合成生物学手段重构囊壁形成通路。这些突破将推动新型抗疟策略的诞生,并为真核生物发育生物学研究提供范式参考。





